30KD-10KD选用15%胶。4.2 要根据样品浓度来加样品溶解液。每加一个样品后换一支吸头或清洗吸头后再点另一个样品。4.3 制备聚丙烯酰胺凝胶时,倒胶后常漏出胶液,那是因为二块玻璃板与塑料条之间没封紧,留有空隙,所以这步要特别留心操作.4.4 电泳完毕撬板取凝胶时要小心细致不能把胶弄破。 4.5 电泳缓冲液可重复利用,如果胶上出现不正常痕迹,就要及时更换新液。4.6 分离胶高度控制得当,确保有大约1cm左右的浓缩胶空间。过长或过短均不能得到理想的电泳结果。4.7 电泳染色液注意进行回收再利用,一般可重复使用2-3次。4.8 AP和TEMED是催化剂,加入的量要合适,过少则凝胶聚合很慢甚**不聚合,过多则聚合过快,影响倒胶。
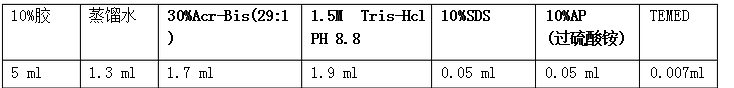
2、 配制分离胶(12%)(10ml):
将分离胶上的水倒去,并用滤纸吸干多余水份,加入上述混合液,立即将梳子插入玻璃板间,完全聚合需15-30min。 4、待积层胶完全聚合后,小心拔出梳子,然后将玻璃板固定在电泳槽上。
5、样品处理:将样品加入等量的2×SDS上样缓冲液,100℃加热3-5min, 12000g离心1min,取上清作SDS-PAGE分析,同时将SDS低分子量蛋白质Marker作平行处理。
6、上样:取10μl诱导与未诱导的处理后的样品加入样品池中,并加入20μl低分子量蛋白Marker作对照。
7、电泳:在电泳槽中加入1电泳缓冲液,连接电源,电泳时,积层胶电压80V,分离胶电压120V,电泳**溴酚蓝行**电泳槽下端停止(约需2-3h)。
8、染色:将胶从玻璃板中取出,置于考马斯亮蓝染色液中染色,室温4-6h。 9、脱色:将胶从染色液中取出,放入脱色液中,多次脱色**蛋白带清晰。 #p#分页标题#e#
10、凝胶摄像和保存:将脱色好的凝胶摄像,凝胶可保存于双蒸水中或7%乙酸溶液中。 注意事项:
1、实验组与对照组所加总蛋白含量要相等。
2、为达到较好的凝胶聚合效果,缓冲液的pH值要准确,10%AP在一周内使用。室温较低时,TEMED的量可加倍。 3、未聚合的丙烯酰胺和亚甲双丙烯酰胺具有神经毒性,可通过皮肤和呼吸道吸收,应注意防护。 试剂配制:
30%丙烯酰胺(29:1)配制:称取Acrylamide 29 g、Bisacrylamide 1 g,加入约60 ml的去离子水,充分搅拌溶
解。加去离子水将溶液定容**100 mL,用0.45um滤膜滤去杂质,于中4℃避光保存。 5×Tris-Glycine电泳缓冲液的配制:称取Tris-base 15.1 g、Glycine 94 g、SDS 5 g置于1 L烧杯中,加入约800
mL的去离子水,搅拌溶解;加去离子水将溶液定容**1 L后,室温保存。
10 %过硫酸胺(AP)的配制:称取过硫酸胺0.1 g 溶于1.0 mL 灭菌的去离子水中,充分混匀后于4 ℃避光保
存,保存时间不能超过1周。
10 % SDS的配制:称取SDS 10 g溶于100 mL灭菌的去离子水中并于50℃水浴下溶解,室温保存。如在长
期保存中出现沉淀,水浴溶化后,仍可使用。
1.5mol/L Tris-HCl(pH8.8):称取Tris-base 45.43 g,加入约200 mL去离子水,搅拌溶解;用浓盐酸调pH**
8.8,**后用去离子水定容**250 mL,室温下保存。
0.5mol/L Tris-HCl(pH6.8):称取Tris-base 15.14 g,加入约200 mL去离子水,搅拌溶解;用浓盐酸调pH**
6.8,**后用去离子水定容**250 mL,室温下保存。
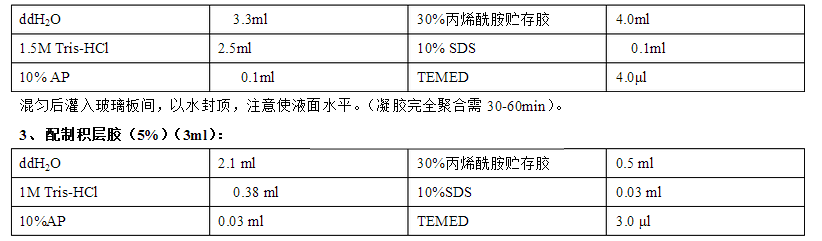
12 % SDS-PAGE 分离胶:30%丙烯酰胺4 mL、去离子水3.3 mL、1.5mol/L Tris-HCl(pH8.8)2.5 mL、10 % AP
100 μL、10 % SDS 100 μL和TEMED 5 μL充分混匀后灌胶。
15 % SDS-PAGE 分离胶:30%丙烯酰胺5 mL、去离子水2.3 mL、1.5mol/L Tris-HCl(pH8.8)2.5 mL、10 % AP
100 μL、10 % SDS 100 μL和TEMED 5 μL充分混匀后灌胶。
5 % SDS-PAGE 浓胶:30%丙烯酰胺0.5 mL、去离子水2.1 mL、0.5mol/L Tris-HCl(pH6.8)0.375 mL、10 % AP
30 μL、10 % SDS 30 μL和TEMED 5 μL充分混匀后灌胶。
考马斯亮蓝染色液的配制:称取1 g考马斯亮蓝R-250,置于1 L烧杯中;量取250 mL异丙醇加入上述烧杯
中,搅拌溶解;加入100 mL的冰醋酸,搅拌均匀;加入650 mL去离子水,搅拌均匀;用滤纸除去颗粒物质后,室温保存备用。
脱色液的配制:量取冰醋酸 100 mL、乙醇50 mL,加去离子水定溶**1L,搅拌均匀,室温保存备用。
转移缓冲液的配制:称取Tris-base 1.45 g、甘氨酸7.2 g,加入约200 mL去离子水,搅拌溶解;加入100 mL
甲醇,**后用去离子水定容**500 mL,室温下保存备用。
洗膜缓冲液(TBST)的配制:称取NaCl 8.8 g、Tris-base 2.42 g,向烧杯中加入约800 mL去离子水,充分搅拌
溶解;用1 M HCl将溶液的pH值调**7.5,加入0.5 mL Tween 20后充分混匀;加去离子水将溶液定容**1 L后,于4 ℃保存备用。
封闭缓冲液的配制:称取0.5 g脱脂奶粉溶于10 mL TBST缓冲液中,充分混匀后备用。
0.1 M 甘氨酸缓冲液配制:称取0.75 g甘氨酸加入90 mL去离子水,充分溶解后用pH计将pH值调**2.5,用去离子水定容**100mL后用0.22 µm 微孔虑膜过滤除菌后,将其分装并于4 ℃保存备用。
1 M Tris-HCl 缓冲液的配制:称取12.1g Tris-base,加入90 mL去离子水,充分溶解后用pH计将pH值调**
7.5,用去离子水定容**100mL备用。 银染固定液:30 % 的乙醇,10%的乙酸。
银染氧化液:称取0.7 g高碘酸溶于100 mL去离子水,充分混匀备用。 银染显色液:浓度为0.005 g/L的柠檬酸,0.02 %的甲醛。
银氨溶液:浓度为0.67 % 的硝酸银,0.33 %的氨水,0.8 g/L的NaOH。