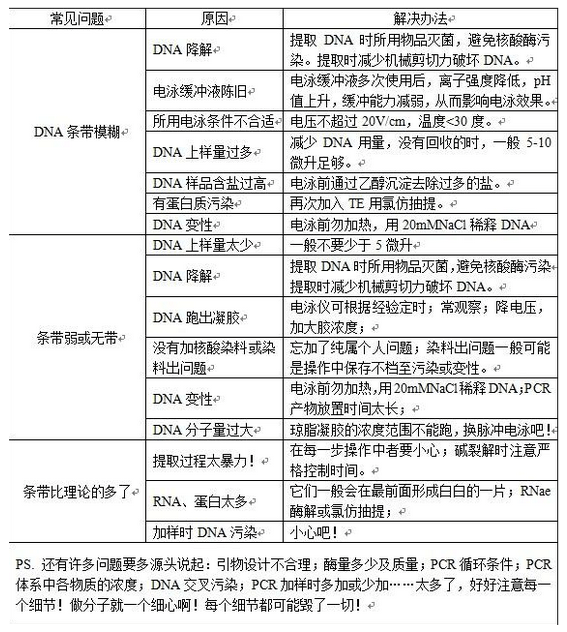
核酸分子是两性解离分子,在高于其等电点的电泳缓冲液(pH8.0-8.3)中,基其碱基不解离,而磷酸基团全部解离,核酸分子因而带负电荷,电泳时向正极迁移。琼脂糖主要多海洋植物琼脂中提取而来并经糖基化修饰,为一种聚合链线性分了,使用琼脂糖凝胶作为电泳支持介质,发挥分子筛功能,使得大小和构象不同的核酸分子的迁移率出现较大差异,从而达到分离的目的。琼脂糖凝胶电泳操作简单、快速、通过调整其使用浓度,使得分辨率达到大多实验的要求。因此成为分离、鉴定、纯化核酸分子的常用方法。 一、操作过程中要注意以下一些问题。 1、凝胶制作 1.1 凝胶浓度
凝胶的浓度据实验需要而变,一般在1.8%-2.0%之间,没有用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定。补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充水分到原刻度;二是在煮胶前称重,煮胶后补充水**原重量。粗略一点的办法是通过多次较恒定的煮胶条件得出一个经验补水值,以保证凝胶浓度基本维持在原浓度。如果条带要回收**好不要用回收胶。
1.2 梳板的选用
一般每个制胶模具均配有多个齿型不同的梳板。梳齿宽厚,形成的点样孔容积较大,用于DNA片段回收实验等;相反,梳齿窄而薄,形成的点样孔容积就较小,用于PCR产物、酶切产物鉴定等。回收的话还可以将几个齿用透明胶带粘起来,形成一个窄而长的大孔以加大点样量提高回收率。梳板的选择主要是看上样量的多少而定。一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。另外,每次制胶时都要注意梳齿与底板的距离**少要1mm,否则,拔梳板时易损坏凝胶孔底层,导致点样后样品渗漏。当然,点样孔的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30min以上方可拔出梳板,应急的情况下可以将成型的凝胶块入4度冰箱中冷却15min左右,拔梳板的方法是将制胶槽放置在
电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孔。 2、点样
在样品加入上样缓冲液中含有甘油或蔗糖以增加密度,使样品沉入孔底;上样缓冲液中一般还含有两种指示剂,溴酚兰和二甲苯菁,用于指示样吕的迁移过程。上样缓冲液储存液一般为6倍(10倍),表示其浓度为工作浓度的六倍。使用时上样缓冲液应稀释到一倍浓度。点样方法是将移液枪基本垂直对准点样孔,用另一只手帮助固定移液枪下端,移液枪的枪头**进入点样孔即可将样品注入孔内。上样量的多少根据跑胶的目的而不同,一般直接跑DNA时量**少,跑一般的分子标记适中,回收时可以都加进去。**后根据扩增条带的大小点上适合的DNA Maker。 3、电泳
将
电泳仪的正极与
电泳槽的正极相连,负极与负极相连,每次电泳时都要检查一下电极方向,以免白干(新手来做时可能就有这样的情况发生)。核酸带负电荷,从负极向正极移动。
电泳槽中电泳缓冲液与制胶用电泳缓冲液应相同,电泳缓冲液刚好浸过胶为好。电泳缓冲液浓度太大则电流加大,凝胶发热,易使DNA降解。电泳早所加电压一般不超过5v/cm(正负电极之间的距离,而不是凝胶的长度)。电泳时间一般为30-60min,根据实验需要也可作适当调整。电压增高,电泳时间缩短,核酸条带相对来说不够整齐,不够清晰;相反,电压降低,电泳时间较长,条带会相对的清晰。另外,如果电泳后样品泳支很慢或者没移动可能是由于挡板没有拿开。
附 EB作用原理:观察琼脂糖凝胶中DNA**常用的方法是利用荧光染料溴化乙锭进行染色,溴化乙锭含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团。它与DNA的结合几乎没有碱基序列特异性。在高离子强度的饱和溶液中,大约每2.5个碱基插入一个溴化乙锭分子。当染料分子插入后,其平面基团与螺旋的轴线垂直并通过范德华力与上下碱基相互作用。这个基团的固定位置及其与碱基的密切接近,导致与DNA结合的染料呈现荧光,其荧光产率比游离溶液中染料有所增加。DNA吸收254nm处的紫外辐射并传递给染料,而被结合的染料本身吸收302nm和366nm的光辐射。这两种情况下,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。由于溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍,所以当凝胶中含有游离的溴化乙锭(0.5ug/ml)时,可以检测到少**10ng的NDA条带。