来自芝加哥大学癌症生物研究所,本-梅癌症研究中心等处的研究人员发明了一种能同时检测大量蛋白的新方法,彻底改变目前我们进行癌症和其它疾病蛋白表达水平检测的技术面貌,这种新方法效果与传统的Western Blotting一样好,但是时间可以大大缩短,比传统Western Blotting快48倍。这一研究成果公布在《Nature Methods》杂志上。
这种称为“micro-western arrays”(微印迹分析)的方法能将蛋白检测常用实验:Western blot的特异识别能力,和DNA芯片检测的高通量能力结合起来,帮助科学家们一次实验就可以观测到细胞中各种蛋白之间的网络系统,节省了每次反复实验的人力和物力。
领导这一研究的芝加哥大学癌症生物研究所资深研究员Richard B. Jones表示,“蛋白才是细胞中真正的行使功能的‘仪器’,但是由于这一系统太复杂,所以还没有科学家能深度剖析它们,现在我们终于能利用这一技术分析蛋白了。”
自上个世纪70年代以来,实验室就开始利用Western blot方法来检测蛋白,这种方法又称为免疫印迹,是将蛋白质转移到膜上,然后利用抗体进行检测,对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。Western blot方法由于蛋白是以非共价键形式吸附在固相载体(例如硝酸纤维素薄膜)上,因此能保持电泳分离的多肽类型及其生物学活性不变,从而被广泛的用于检测蛋白水平的表达。
这一方法导致了细胞生物学领域大量成果的涌现,但是仍然受限于WB实验需要大量细胞原料和昂贵的抗体,而且这一方法也不能同时进行多个蛋白的检测。随着细胞网络中成百上千的蛋白被发现,科学家们越来越希望能分析这些蛋白的活动,和蛋白之间的相互作用。
正如Jones博士说的那样,“当你走进一间黑暗的房间,如果不能获得许多信息,那么很难去预测将会发生什么”,“如果有人点亮了灯,那么我们就不会再磕碰到物体了。”
Micro-western arrays(MWA)技术就是这样的一盏灯,这种方法将芯片技术这种单个实验就能检测出上千基因的工具运用到蛋白上,利用预制的micro-western胶(包含96个微胶(miniature,生物通译)),帮助科学家们同时比较数以百计的蛋白表达,或者一次性比较不同治疗条件下蛋白的情况。而且这种方法只需要纳升级细胞原料和抗体,减少了实验成本,也**大化了单个样品实验能获得的信息。
这种MWA方法具体步骤见下图,研究人员为了能结合微型Western Blots方法和微孔板液体操作方法,首先通过一种96孔板大小的96块统一的非接触芯片胶来预印细胞裂解物,这样6中不同的细胞裂解物也许就能通过96个不同的抗体进行检测,或者24个不同的裂解物通过24个不同的抗体进行检测。为了增加大分子蛋白的转膜率,以及降低小分子蛋白的转膜率,研究人员使用了醋酸盐缓冲液来跑胶。每个蛋白点,每次在胶统一位置加6nl样品,反复10次,这比一次放置60nl,蛋白点密度更大,信号更好。在印迹上样品后,研究人员将这些样品进行半干式蛋白电泳(semidry electrophoresis),12分钟后转**NC膜,进行扫描检测。
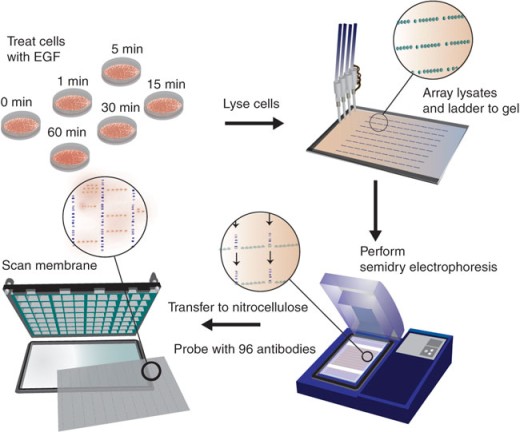
这种高通量分析技术,结合了蛋白芯片分析,将纳升级的样品点在胶上进行电泳,从而可以不同分子量的蛋白进行分离,因此效果与传统的Western Blotting一样好,但是时间可以大大缩短,包含transfer、blocking、washing、2nd antibody需要2天,数据分析约需要2-3天,整个过程大约1周的时间,比传统Western Blotting快48倍。这种新的技术,可以用极少量的样品和抗体分析大量数目不同蛋白的变化,极适合研究干细胞、癌细胞、组织发育等过程中信号传导路径(signaling transduction pathway)的变化。
研究人员将MWA技术与传统的Western Blot技术进行了比较,见下图,左边为传统的WB方法,中间为MWA方法,研究人员利用200ng/ml的EGF刺激A431细胞,然后裂解细胞,获得裂解物,一抗β-actin单克隆抗体鼠抗(IR800 (LI-COR)二抗检测,绿色),和多克隆抗体兔抗(Alexa Fluor 680 二抗检测,红色)证明了两者的检测效果相当。右边是荧光信号变化的折线图。

研究人员也进行了验证实验,他们分析了一个癌细胞系中大量EGFR蛋白的情况,Jones博士说,“我们开始对这些之前从未有人进行的实验进行验证,这些实验证明我们实际上同时能观测120个靶标”。研究发现激活EGFR能同时激活几种不同的细胞受体,这是一项新发现,解释了为什么一些肿瘤能产生癌症治疗抗性。
Jones博士之前还曾合成超过500条含磷酸化酪氨酸的多肽,并且利用E. coli细菌分离数百个人类SH2- and PTB-位点包含蛋白,研究AR受体以及EGFR、MET和KIT的RTK受体被磷酸化酪氨酸后,与人类基因中含SH2-domain或PTB-domain上百个蛋白之间的相互作用。
随着更多实验的进行,这一方法未来也许能用于临床癌症和其它疾病更精确的诊断,或者用于直接个性化治疗,临床实验受限于大多数的癌症都是通过一种,或者两种标记物进行检测,这种方法容易出错,利用MWA方法,Jones博士表示,“我们就能同时进行多种蛋白检测,而不会仅仅局限于单个的猜想,这是之前从未能做到的。”
一些科学家也表示了对这种技术的看好,比如来自哥伦比亚大学生物医药信息学院的Andrea Califano就表示,“我认为这确实是一项技术突破,利用这种方法,我们就能更接近真实情况的模拟修饰后的信号蛋白,它们具有怎样的活性,相互之间如何作用,这在目前的技术条件下是无法实现的”,“这打开了一扇了解细胞分子全貌的窗。”
来自都柏林大学的系统生物学主任Walter Kolch也认为,“系统生物学的**大难题之一就是无法获得高密度,实时性和高质量的数据,micro-western array方法也许能**终解决这一问题”,“这是一个在传统方法基础上,运用新的idea得到一种新技术的好例子。”