Western blot 实验技巧精要
——轻松获得高质量 western blot 条带图
Western blot 方法在 SCI 文章中出现的频率非常高,漂亮的 WB 电泳图可以给文章增色不少。但是 WB 实验的步骤琐碎,细节颇多,要想得到令人满意的结果还是需要花费很多时间和精力去摸索实验技巧的。
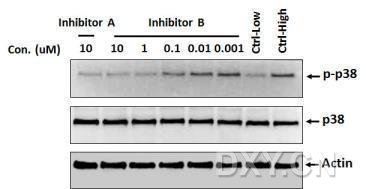
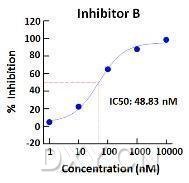
小编经过了一段时间的努力,已经可以比较轻松的实现用 WB 方法对磷酸化蛋白计算药物的 IC50 值(见下图)。
接下来,小编将结合自己的经验以及网上可以搜索到的 WB 实验技巧,为大家介绍一下 WB 实验过程中的关键点。虽然 WB 实验步骤很多,但只要抓中其中的几个重点方面,就可以得到干净、漂亮、清晰、客观的电泳图。
一、 样品准备部分
小编认为,我们不应该太过重视 WB 电泳部分的操作技巧,样品准备才是整个 WB 实验中**重要的一个环节(没有之一)。否则 WB 电泳技术再高也无法得到好的结果。小编认为以下 3 点值得大家重点关注:
1. 注意孵育、终止时间
如果想得到漂亮的梯度条带,无论是不同处理时间的样品,还是不同给药浓度的样品,在处理过程中都一定要严格按照设计的时间来孵育和终止,尤其是对于磷酸化蛋白,哪怕 1 秒也不要提前或耽搁。
2. 抑制蛋白降解
这是样品制备中**需要注意的部分。抑制样品蛋白降解的方法主要有两种:
(1) 使用蛋白酶抑制剂
小编使用的是罗氏公司(Roche)的蛋白酶抑制剂 Cocktail 片剂,效果不错。再与 PMSF 共同使用,可以很好地抑制蛋白降解。
(2) 全程低温操作
提前预冷 PBS、裂解液甚**枪头等,从收集细胞开始一直到煮样的全过程都应该尽可能的保持在冰上操作。小编除了使用冰盒,大多数操作都是在 4℃冷房中进行的,虽然有点麻烦和辛苦,但是效果非常好。
3. 裂解液用量
将收集好的细胞加入裂解液进行裂解在操作上是非常简单的,所以这一步的重要性很容易被大家忽视。裂解液的用量直接决定了细胞裂解程度以及裂解后的蛋白浓度。
如果加入的裂解液不足,蛋白浓度太高,会造成与上样缓冲液反应不充分,电泳后会出现多条条带,条带形状也不好。小编做磷酸化蛋白检测时为了在每个胶孔中尽可能多上样,所以用体积较少的裂解液制备了浓度很高的蛋白,结果就得不偿失了(见下图)。
这种情况的补救方法是给样品继续补加上样缓冲液,煮样,再跑胶。直接给已经煮过样的样品补加上样缓冲液再煮样,跑胶后的效果也会好很多(见下图)。

如果加入的裂解液过多,蛋白浓度太低,会导致在胶孔中的上样量不足,条带不清晰。
那么加入多少体积的裂解液**好呢?小编认为,加入细胞团体积的 10 倍体积的裂解液是一个比较好配比,当然也可以根据目标蛋白进行调整。
二、 WB 电泳部分
得到了高质量的样品就已经很接近成功了,小编接下来为大家介绍一些 WB电泳部分的注意事项。
1. 制胶
小编建议大家直接用制胶试剂盒,价格不贵,质量不错。如果自己配置母液,就请注意 pH 值。
制胶部分**重要的是在配浓缩胶前不要着急将分离胶上面的水弃掉,先配好浓缩胶,在加 TEMED 之前再弃掉水。小编虽然没有亲自试过,但是如果弃掉水后 5 分钟之内还没有加上浓缩胶,这块胶**好还是不要用了。
2. 上样
小编的经验是上样的总蛋白量一般是 20-70ug,这个要根据检测蛋白的含量而定,需要摸索。
计算后每个样品的上样体积如果比较小,用枪头直接上样是完全可以的,如果上样量超过 20ul,**好还是用微量注射器来上样。上样确实是需要多多练习和体会的,上样技术高可以多上 10ul 样品而不溢出。
如果需要上样的体积太大,也可以先上一部分,然后跑几分钟电泳,再停下来继续上样,这是完全可以的,经过下一步的调整,是不会影响效果的。
3. 电泳
每个孔的上样量参差不齐没关系,在样品还没有达到分离胶时用≤60V 的电压可以很好的将样品排列整齐,不容易跑出弧线或者不齐的线。
当样品达到分离胶后,通常会改成 100V 继续电泳,小编认为如果时间充足,电压低一点效果不错。
请注意:电压改一次就好,不要多次调整。
4. 转膜
在转膜环节小编认为**重要的,也是**容易被大家忽视的一步是:预冷电转液。大家一定感觉到过,电转液加入甲醇后温度会迅速上升,所以建议跑上电泳就配电转液,加入甲醇后放入 4℃冰箱预冷。#p#分页标题#e#
当然,也不要忘了赶气泡,赶气泡时方向不要太随意,也不要太用力,否则可能会使胶变形,尤其是边缘部分,然后你的条带就会……比较有艺术感了……(见下图)

**后别忘了膜需要先在甲醇中浸泡一下,然后在电转液中洗一洗再使用。
5. 封闭、一抗、二抗
很多 WB 技巧介绍都会根据曝光后的电泳图的效果指出需要降低或提高一抗的稀释倍数,延长或减少二抗孵育时间等等。小编认为只要按照说明书上推荐的比例做就没有问题。出现各种条带不好的情况,更大的可能是前面步骤中出现了问题,而不是这一步。
如果是用杂交袋进行一抗和二抗的孵育,小编建议大家在放入膜后,将杂交袋中的 TBS-T 赶出来,然后再加入一抗或二抗,这样一抗和二抗就不会被膜上残留的 TBS-T 稀释了。
6. 曝光
当电泳图上的条带不够好时,曝光相关参数也是经常被认为是需要调整的部分。小编依然认为,曝光不是关键的步骤,前面做好了,曝光是很简单的。小编用的是 ECL 发光液曝光法。这种方法**需要注意的就是 ECL 要在条带上分布均匀。小编用的是普通自封袋,将膜放在一片自封袋上,加上发光液后,再盖上一片自封袋,用手指赶一下,发光液就会比较均匀,效果不错。
以上就是小编认为 WB 实验中**需要注意的部分,相信做好以上内容,做WB 实验会成为一项乐趣。小编想再次提醒一下大家,样品制备部分是非常重要的,拼技术和经验主要在这一部分。相比之下,WB 电泳部分虽然也有一定的技巧,但更多的是拼态度。小编很喜欢 WB 实验,希望这些技巧能够帮助您爱上western blot 实验!