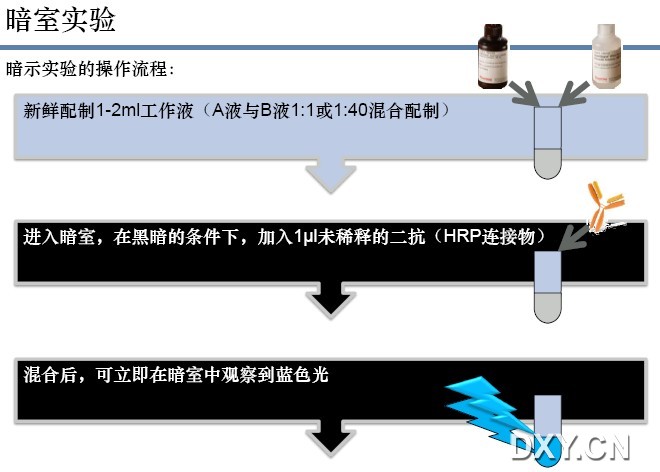
暗室实验
暗室实验的操作流程:
1. 新鲜配制1-2ml工作液(A液与B液1:1或1:40混合配制)
2. 进入暗室,在黑暗的条件下,加入1μl未稀释的二抗(HRP连接物)
3. 混合后,可立即在暗室中观察到蓝色光
 暗室实验的注意事项:
暗室实验的注意事项:
工作液按正确比例混合,且新鲜配制
在暗室中加入二抗
直接使用未稀释的二抗
加入二抗后,立即观察
注:暗室实验可同时检测底物是否有活性,以及二抗是否有活性。
如果暗室实验结果阴性:
更换其它二抗,再次进行检测;再次检测结果仍为阴性,证明底物丧失活性。
暗室实验结果阳性:
认为二抗及底物活性良好; Western Blot 系统需要进一步优化
优化抗原和抗体浓度的斑点杂交方法:斑 点 杂 交 方 法——优 化 抗 原 和 抗 体 浓 度
对于一个给定的抗原,**佳的抗体浓度依赖的抗原和抗体本身。抗原和抗体的亲和力,以及一抗与二抗的特异反应都是不同的。**优抗原和抗体浓度可通过免疫印迹实验中使用不同浓度的抗原和抗体作用确定。另外,更快和更简单的方法是进行斑点印迹实验。以下是使用超敏感信号底物进行的斑点印迹的操作方法。
注:所有的抗体稀释度假定起始浓度为1 mg/mL。
1. 用TBS 和PBS 稀释的蛋白样品,好的稀释方法是由样品中的抗原稀释浓度决定的,但是由于抗原的浓度是未
知的, 所以有必要进行宽范围的稀释度的检测。SuperSignal West Pic 化学发光底物的检测灵敏度可达皮g 水平,所以样品的稀释范围可以从微克水平到皮克水平。如果要使用过多的抗原,结果会出现以下情况:非特异性条带、模糊条带和信号降低。
2. 准备转印膜。所需膜的数量依赖于被屏蔽的一抗和/或二抗有多少种不同稀释浓度。通常,一种或两种一抗的稀
释度是用两种或三种不同的二抗稀释度进行测定的。例如:1/1000 的一抗和1/50000 的二抗;1/1000 的一抗和1/100000 的二抗;1/5000 的一抗和1/50000 的二抗;以及1/5000 和1/100000 的二抗。
3. 将膜放在滤纸上。将抗原稀释液点在膜上。用尽可能小量的稀释液点在膜上(2-5 ul 为宜),因为用的体积越大,信号越弥散。抗原溶液在膜上干10-30 分钟或直**无可见的水分。
4. 用含0.05%的Tween-20 封闭液封闭膜上的非特异性点,室温震荡孵育1 h。
5. 将一抗稀释到封闭液/Tween-20 去污剂中,并加到膜上,室温震荡孵育1h。
6. 用TBS 或PBS 洗膜4-6 次,用尽可能大体积的洗脱液,在洗脱液中加入0.05%的吐温,用以减少非特异背景。每次洗脱过程中,使膜悬浮在洗脱液中震荡大约5 分钟,倒出洗脱液并重复。孵育前,在洗脱液中短时间的漂洗可能会增加洗脱效率。
7. 制备二抗/HRP 结合的封闭试剂/Tween-20 去垢剂稀释液,将二抗稀释液加到膜上震荡孵育1 h。
8. 按第6 步方法再次清洗膜。
9. 准备底物工作缓冲液,混合等体积的鲁米诺/增强剂和稳定的过氧化物溶液。制备足够体积确保印迹点完全湿润,保证印迹点在孵育过程中不会干。推荐体积:0.1 ml/cm2印迹面。
10. 将膜在超感应显色底物工作液中孵育5 分钟;
11. 将膜从底物上移除,放到塑料布或其它防护膜上;
12. 将印迹贴到胶片上,在蛋白旁边曝光。任何标准的或者增强的放射自显影胶片都可以用。推荐**次曝光30-60 s,为得到**佳结果,曝光时间可不同。另外,也可用CCD 相机或其它成像设施;然而这些设施可能需要更长的曝光时间。
13. 在**佳的印迹膜上,超感应反应底物产生的信号可能会持续超过8 h。未获得**佳结果,印迹能重复曝光到胶片上或者成像系统中。随印迹时间的延长,需延长曝光时间。如果未得到**佳结果,可用抗原和/或抗体稀释液重复进行这个程序。
